The good, the bad and the spliceosome!
Das Protein RBM5 hilft, den Spleiß-Apparat zur Boten-RNA zu bringen, indem es an eines dieser Proteine bindet. Dadurch entscheidet RBM5, welche Isoform von Fas hergestellt wird. (Video) Quelle: Helmholtz Zentrum München
Wir kennen das Problem: Beim Aufbauen der Einkäufe aus dem Möbelhaus verwenden alle denselben Bauplan. Dennoch kann sich im Laufe mehrerer Zwischenschritte das Endprodukt stark unterscheiden. Etwas ganz ähnliches kann passieren, wenn aus Genen Proteine werden.
Denn das Erbgut (der Bauplan) wird zunächst in ein Botenmolekül, die mRNA, umgeschrieben, um diese dann in Proteine (Möbel) zu übersetzen. Doch die mRNA kann durch Zwischenschritte, die der Fachmann alternatives Spleißen nennt, verändert und zurechtgeschnitten werden, so dass letztlich aus demselben Bauplan unterschiedliche Proteine hergestellt werden.
Ein interessantes Beispiel für alternatives Spleißen ist die mRNA des Fas-Gens.* Je nachdem, welche Zwischenschritte stattfinden, kann das fertige Protein den kontrollierten Zelltod (die Apoptose) entweder verhindern oder begünstigen.
„Die richtige Balance dieser gegensätzlichen Prozesse ist abhängig vom Zelltyp und kann bei Fehlregulation zu unkontrolliertem Zellwachstum und Krebserkrankungen führen“, erklärt Prof. Dr. Michael Sattler, Direktor des Instituts für Strukturbiologie (STB) am Helmholtz Zentrum München. Gemeinsam mit seinem Kollegen Prof. Dr. Juan Valcárcel Juárez vom Centre de Regulació Genòmica (CRG) in Barcelona haben er und sein Team nun detaillierte Erkenntnisse gewonnen, welche Zwischenschritte ablaufen und wie diese zu den verschiedenen Formen des Fas-Proteins führen.
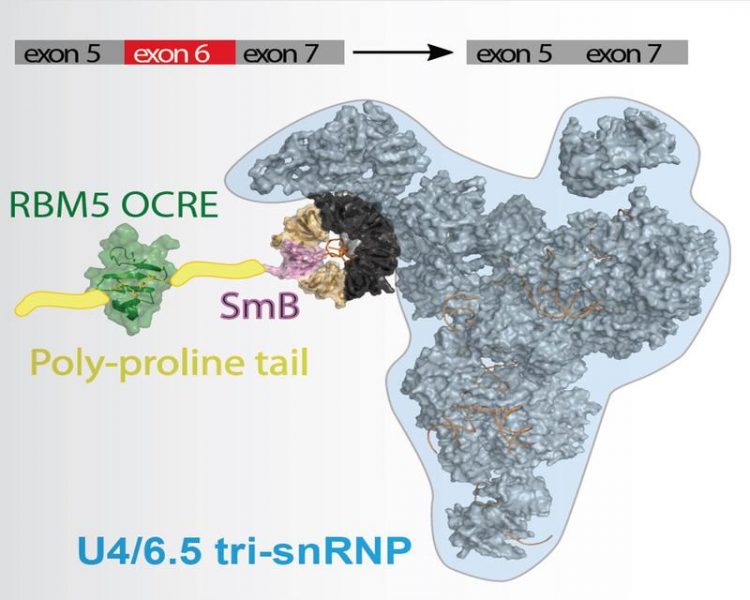
„Im Mittelpunkt unseres Interesses stand das Protein RBM5, das bei Lungentumoren oft Mutationen aufweist“, so Dr. André Mourão vom STB. „RBM5 dient als Verbindungsstück zwischen der mRNA und den Proteinen des Spleiß-Apparates“, erläutert die Koautorin Dr. Sophie Bonnal vom CRG Barcelona weiter. In dieser zentralen Position entscheide RBM5 darüber, welche Form von Fas exprimiert werde und steuere so die Balance zwischen den beiden Formen.**
„Durch unsere Untersuchungen mittels Kernspinresonanz (engl.: nuclear magnetic resonance, NMR)-Spektroskopie am Bayerischen NMR-Zentrum in Garching konnten wir die Raumstruktur aufklären, und verstehen wie diese Wechselwirkungen exakt stattfinden“, erläutert Studienleiter Sattler.*** Um ihre Ergebnisse zu bestätigen, mutierten die Wissenschaftlerinnen und Wissenschaftler die entsprechenden Interaktionsstellen der Proteine im Reagenzglas und konnten feststellen, dass die gefundenen Wechselwirkungen in der Zellkultur daraufhin nicht mehr stattfanden.
„Der Prozess des alternativen Spleißens betrifft zahlreiche Funktionen und Prozesse und eine Fehlregulation kann Krebserkrankungen auslösen. Daher ist das Verständnis für die genauen Vorgänge von großer Wichtigkeit“, ordnet Sattler die Ergebnisse ein. Den Autoren zufolge wurden in derartiger Strukturtiefe bisher nur wenige Proteininteraktionen analysiert, die das alternative Spleißen beeinflussen. Künftig wollen die Forscher exakt bestimmen, wie RBM5 an die mRNA bindet und ob es zusätzliche Interaktionen mit dem Spleißapparat gibt, der aus zahlreichen weiteren Komponenten besteht.
Weitere Informationen
* Fas ist auch bekannt als CD95 oder APO-1. Je nachdem, ob ein bestimmter Bereich (Exon 6) in der mRNA enthalten ist oder nicht, entsteht ein membranständiges pro-apoptotisches Protein oder eine lösliche Form im Zellinneren, die der Apoptose entgegen wirkt. Als pro-apoptotisches Protein verhindert Fas, dass sich irrläufige Zellen unkontrolliert vermehren, während die anti-apoptotische Form dazu führt, dass sich solche Zellen ausbreiten können.
** Der Name ist ein Akronym für (engl.) RNA Binding Motif 5. Bei RBM5 handelt es sich um ein Protein, was in verschiedenen Krebsarten (speziell in der Lunge) nachweislich falsch reguliert wird.
*** Eine sogenannte OCRE (octamer repeat of aromatic residues) Domäne des Proteins RBM5 bindet an den C-terminus des spleißosomalen Proteins SmN und ist so wichtig für die Regulation des alternativen Spleißens.
Hintergrund:
Prof. Dr. Sattler ist neben seiner Tätigkeit am Helmholtz Zentrum München auch Lehrstuhlinhaber für Biomolekulare NMR-Spektroskopie an der Technischen Universität München. Er leitet das gemeinsam von TUM und HMGU betriebene Bayerische NMR-Zentrum (http://www.bnmrz.org). Weiterhin an der Studie beteiligt waren das Institució Catalana de Recerca i Estudis Avançats (ICREA) im spanischen Barcelona und das Institut de Génétique Moléculaire de Montpellier in Frankreich.
Original-Publikation:
Mourão, A. & Bonnal, S. & Soni, K. & Warner, L. et al. (2016): Structural basis for the recognition of spliceosomal SmN/B/B’ proteins by the RBM5 OCRE domain in splicing regulation. eLife, doi: 10.7554/eLife.14707
https://elifesciences.org/content/5/e14707
Verwandte Artikel:
In Form für den richtigen Schnitt
http://www.helmholtz-muenchen.de/presse-medien/pressemitteilungen/2016/pressemit…
Richtfest für Neubau des Bayerischen Kernresonanz-Zentrums
http://www.helmholtz-muenchen.de/presse-medien/pressemitteilungen/2016/pressemit…
Roquin erkennt neu entdecktes RNA-Motiv in Genen
http://www.helmholtz-muenchen.de/presse-medien/pressemitteilungen/2016/pressemit…
Das Helmholtz Zentrum München verfolgt als Deutsches Forschungszentrum für Gesundheit und Umwelt das Ziel, personalisierte Medizin für die Diagnose, Therapie und Prävention weit verbreiteter Volkskrankheiten wie Diabetes mellitus und Lungenerkrankungen zu entwickeln. Dafür untersucht es das Zusammenwirken von Genetik, Umweltfaktoren und Lebensstil. Der Hauptsitz des Zentrums liegt in Neuherberg im Norden Münchens. Das Helmholtz Zentrum München beschäftigt rund 2.300 Mitarbeiter und ist Mitglied der Helmholtz-Gemeinschaft, der 18 naturwissenschaftlich-technische und medizinisch-biologische Forschungszentren mit rund 37.000 Beschäftigten angehören. http://www.helmholtz-muenchen.de
Das Institut für Strukturbiologie (STB) erforscht die Raumstruktur biologischer Makromoleküle, analysiert deren Struktur und Dynamik und entwickelt NMR-spektroskopie Methoden für diese Untersuchungen. Ziel ist es, molekulare Mechanismen der biologischen Aktivität dieser Moleküle und ihre Beteiligung an Krankheiten aufzuklären. Die Strukturdaten werden als Grundlage für die rationale Entwicklung kleiner Molekülinhibitoren in Verbindung mit Ansätzen der chemischen Biologie angewandt. http://www.helmholtz-muenchen.de/stb
Die Technische Universität München (TUM) ist mit mehr als 500 Professorinnen und Professoren, rund 10.000 Mitarbeiterinnen und Mitarbeitern und 40.000 Studierenden eine der forschungsstärksten Technischen Universitäten Europas. Ihre Schwerpunkte sind die Ingenieurwissenschaften, Naturwissenschaften, Lebenswissenschaften und Medizin, verknüpft mit Wirtschafts- und Sozialwissenschaften. Die TUM handelt als unternehmerische Universität, die Talente fördert und Mehrwert für die Gesellschaft schafft. Dabei profitiert die TU München von starken Partnern in Wissenschaft und Wirtschaft. Weltweit ist sie mit einem Campus in Singapur sowie Verbindungsbüros in Brüssel, Kairo, Mumbai, Peking, San Francisco und São Paulo vertreten. An der TUM haben Nobelpreisträger und Erfinder wie Rudolf Diesel, Carl von Linde und Rudolf Mößbauer geforscht. 2006 und 2012 wurde sie als Exzellenzuniversität ausgezeichnet. In internationalen Rankings gehört sie regelmäßig zu den besten Universitäten Deutschlands. http://www.tum.de
Ansprechpartner für die Medien:
Abteilung Kommunikation, Helmholtz Zentrum München -Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH), Ingolstädter Landstraße 1, 85764 Neuherberg, Tel. +49 89 3187-2238, E-Mail: presse@helmholtz-muenchen.de
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Michael Sattler, Helmholtz Zentrum München -Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH), Institut für Strukturbiologie, Ingolstädter Landstraße 1, 85764 Neuherberg, Tel. +49 89 3187 3800 E-Mail: sattler@helmholtz-muenchen.de
Media Contact
All latest news from the category: Life Sciences and Chemistry
Articles and reports from the Life Sciences and chemistry area deal with applied and basic research into modern biology, chemistry and human medicine.
Valuable information can be found on a range of life sciences fields including bacteriology, biochemistry, bionics, bioinformatics, biophysics, biotechnology, genetics, geobotany, human biology, marine biology, microbiology, molecular biology, cellular biology, zoology, bioinorganic chemistry, microchemistry and environmental chemistry.
Newest articles

Combatting disruptive ‘noise’ in quantum communication
In a significant milestone for quantum communication technology, an experiment has demonstrated how networks can be leveraged to combat disruptive ‘noise’ in quantum communications. The international effort led by researchers…

Stretchable quantum dot display
Intrinsically stretchable quantum dot-based light-emitting diodes achieved record-breaking performance. A team of South Korean scientists led by Professor KIM Dae-Hyeong of the Center for Nanoparticle Research within the Institute for…

Internet can achieve quantum speed with light saved as sound
Researchers at the University of Copenhagen’s Niels Bohr Institute have developed a new way to create quantum memory: A small drum can store data sent with light in its sonic…





















